जल या पानी एक आम रासायनिक पदार्थ है जो जीवन के सभी ज्ञात रूपों के जीवित रहने के लिए जरूरी है। आमतौर पर जल अपनी द्रव अवस्था मे उपयोग में लाया जाता है पर यह ठोस अवस्था, बर्फ और गैस अवस्था, जल वाष्प या भाप रूप मे भी पाया जाता है। पृथ्वी का लगभग 71% सतह को 1.460 पीटा टन (पीटी) (1021 किलोग्राम) जल से आच्छदित है जो अधिकतर महासागरों और अन्य बड़े जल निकायों का हिस्सा होता है इसके अतिरिक्त, 1.6% भूमिगत जल एक्वीफर और 0.001% जल वाष्प और बादल (इनका गठन हवा मे जल के निलंबित ठोस और द्रव कणों से होता है) के रूप मे पाया जाता है।[1] खारे जल के महासागरों मे पृथ्वी का कुल 97%, हिमनदों और ध्रुवीय बर्फ चोटिओं मे 2.4%, और अन्य स्रोतों जैसे नदियों, झीलों और तालाबों मे 0.6% जल पाया जाता है। पृथ्वी पर जल की एक बहुत छोटी मात्रा, पानी की टंकिओं, जैविक निकायों, विनिर्मित उत्पादों के भीतर, और खाद्य भंडार मे निहित है। बर्फीली चोटिओं, हिमनद, एक्वीफर या झीलों का जल कई बार धरती पर जीवन के लिए साफ जल उपलब्ध कराता है।
जल लगातार एक चक्र मे घूमता रहता है जिसे जलचक्र कहते है, इसमे वाष्पीकरण या ट्रांस्पिरेशन,वर्षा और बह कर सागर मे पहँचना शामिल है। हवा जल वाष्प को स्थल के उपर उसी दर से उड़ा ले जाती है जिस गति से यह बहकर सागर मे पहँचता है लगभग 36 Tt (1012किलोग्राम) प्रति वर्ष। भूमि पर 107 Tt वर्षा के अलावा, वाष्पीकरण 71 Tt प्रति वर्ष का अतिरिक्त योगदान देता है। साफ और ताजा पेयजल मानवीय और अन्य जीवन के लिए आवश्यक है, लेकिन दुनिया के कई भागों में खासकर विकासशील देशों मे भयंकर जलसंकट है, और अनुमान है कि 2025 तक विश्व की आधी जनसंख्या इस जलसंकट से दो-चार होगी।.[2] जल विश्व अर्थव्यवस्था में एक महत्वपूर्ण भूमिका निभाता है, क्योकि यह रासायनिक पदार्थों की एक विस्तृत श्रृंखला के लिए विलायक के रूप में कार्य करता है और औद्योगिक प्रशीतन और परिवहन को सुगम बनाता है। मीठे जल की लगभग 70% मात्रा की खपत कृषि मे होती है। [3]
जल के प्रकार
जल तीन अवस्थाओं में पाया जाता है, यह उन कुछ पदार्थों मे से है जो पृथ्वी पर प्राकृतिक रूप से सभी तीन अवस्थाओं में मिलते हैं। जल पृथ्वी पर कई अलग अलग रूपों मे मिलता है: आसमान में जल वाष्प और बादल; समुद्र में समुद्री जल और कभी कभी हिमशैल; पहाड़ों में हिमनद और नदियां ; और तरल रूप मे भूमि पर एक्वीफर के रूप में।
जल मे कई पदार्थों को घोला जा सकता है जो इसे एक अलग स्वाद और गंध प्रदान करते है। वास्तव में, मानव और अन्य जानवरों समय के साथ एक दृष्टि विकसित हो गयी है जिसके माध्यम से वो जल के पीने को योग्यता का मूल्यांकन करने में सक्षम होते हैं और वह बहुत नमकीन या सड़ा हुआ जल नहीं पीते हैं। मनुष्य ठंडे से गुनगुना जल पीना पसंद करते हैं; ठंडे जल मे रोगाणुओं की संख्या काफी कम होने की संभावना होती है। शुद्ध पानी H2O स्वाद मे फीका होता है जबकि सोते(झरने) के पानी या लवणित जल (मिनरल वाटर) का स्वाद इनमे मिले खनिज लवणों के कारण होता है। सोते (झरने) के पानी या लवणित जल की गुणवत्ता से अभिप्राय इनमे विषैले तत्वों, प्रदूषकों और रोगाणुओं की अनुपस्थिति से होता है।
रसायनिक और भौतिक गुण
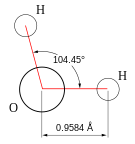
जल एक रसायनिक पदार्थ है जिसका रसायनिक सूत्र H2O है: जल के एक अणु मे दो हाइड्रोजन के परमाणुसहसंयोजक बंध के द्वारा एक ऑक्सीजन के परमाणु से जुडे़ रहते हैं।
जल के प्रमुख रसायनिक और भौतिक गुण हैं:
जल सामान्य तापमान और दबाव में एक फीका, बिना गंध वाला तरल है। जल और बर्फ़ का रंग बहुत ही हल्के नीला होता है, हालांकि जल कम मात्रा में रंगहीन लगता है। बर्फ भी रंगहीन लगती है, और जल वाष्प मूलतः एक गैस के रूप में अदृश्य होता है। [4]
- जल पारदर्शी होता है, इसलिए जलीय पौधे इसमे जीवित रह सकते हैं क्योंकि उन्हे सूर्य की रोशनी मिलती रहती है। केवल शक्तिशाली पराबैंगनी किरणों का ही कुछ हद तक यह अवशोषण कर पाता है।
ऑक्सीजन की वैद्युतऋणात्मकता हाइड्रोजन की तुलना में उच्च होती है जो जल को एक ध्रुवीय अणु बनाती है। ऑक्सीजन कुछ ऋणावेशित होती है, जबकि हाइड्रोजन कुछ धनावेशित होती है जो अणु को द्विध्रुवीय बनाती है। प्रत्येक अणु के विभिन्न द्विध्रुवों के बीच पारस्परिक संपर्क एक शुद्ध आकर्षण बल को जन्म देता है जो जल को उच्चपृष्ट तनाव प्रदान करता है।
- एक अन्य महत्वपूर्ण बल जिसके कारण जल अणु एक दूसरे से चिपक जाते हैं, हाइड्रोजन बंध है.[5]
- जल का क्वथनांक (और अन्य सभी तरल पदार्थ का भी) सीधे बैरोमीटर का दबाव से संबंधित होता है। उदाहरण के लिए, एवरेस्ट पर्वत के शीर्ष पर, जल 68 °C पर उबल जाता है जबकि समुद्रतल पर यह 100 °C होता है. इसके विपरीत गहरे समुद्र मे भू-उष्मीय छिद्रों के निकट जल का तापमान सैकड़ों डिग्री तक पहुँच सकता है और इसके बावजूद यह द्रवावस्था मे रहता है।
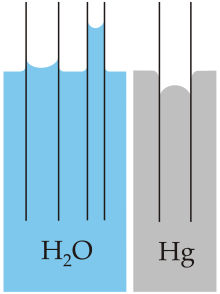
- जल का उच्च पृष्ट तनाव, जल के अणुओं के बीच कमजोर अंतःक्रियाओं के कारण होता है (वान डर वाल्स बल) क्योंकि यह एक ध्रुवीय अणु है। पृष्ट तनाव द्वारा उत्पन्न यह आभासी प्रत्यास्था (लोच), केशिका तरंगों को चलाती है।
- अपनी ध्रुवीय प्रकृति के कारण जल मे उच्च आसंजक गुण भी होते है।
- केशिका क्रिया, जल को गुरुत्वाकर्षण से विपरीत दिशा मे एक संकीर्ण नली मे चढ़ने को कहते हैं। जल के इस गुण का प्रयोग सभी संवहनी पौधों द्वारा किया जाता है।
- जल एक बहुत प्रबल विलायक है, जिसे सर्व-विलायक भी कहा जाता है. वो पदार्थ जो जल मे भलि भाँति घुल जाते है जैसे लवण, शर्करा, अम्ल, क्षार, और कुछ गैसें विशेष रूप से ऑक्सीजन, कार्बन डाइऑक्साइड उन्हेहाइड्रोफिलिक (जल को प्यार करने वाले) कहा जाता है, जबकि दूसरी ओर जो पदार्थ अच्छी तरह से जल के साथ मिश्रण नहीं बना पाते है जैसे वसा और तेल, हाइड्रोफोबिक (जल से डरने वाले) कहलाते हैं।
- शुद्ध जल की विद्युत चालकता कम होती है, लेकिन जब इसमे आयनिक पदार्थ सोडियम क्लोराइड मिला देते है तब यह आश्चर्यजनक रूप से बढ़ जाती है।
- अमोनिया के अलावा, जल की विशिष्ट उष्मा क्षमता किसी भी अन्य ज्ञात रसायन से अधिक होती है, साथ ही उच्च वाष्पीकरण ऊष्मा (40.65 kJ mol−1) भी होती है, यह दोनों इसके अणुओं के बीच व्यापक हाइड्रोजन बंधों का परिणाम है। जल के यह दो असामान्य गुण इसे तापमान में हुये उतार-चढ़ाव का बफ़रण कर पृथ्वी की जलवायु को नियमित करने पात्रता प्रदान करते हैं।
- जल का घनत्व अधिकतम 3.98 °C पर होता है.[6] जमने पर जल का घनत्व कम हो जाता है और यह इसका आयतन 9% बढ़ जाता है। यह गुण एक असामान्य घटना को जन्म देता जिसके कारण: बर्फ जल के उपर तैरती है और जल मे रहने वाले जीव आंशिक रूप से जमे हुए एक तालाब के अंदर रह सकते हैं क्योंकि तालाब के तल पर जल का तापमान 4 °C के आसपास होता है।
- जल कई तरल पदार्थ के साथ मिश्रय होता है, जैसे इथेनॉल, सभी अनुपातों में यह एक एकल समरूप तरल बनाता है। दूसरी ओर, जल और तेल अमिश्रय होते हैं और मिलाने परत बनाते है और इन परतों मे सबसे उपर वाली परत का घनत्व सबसे कम होता है. गैस के रूप में, जल वाष्प पूरी तरह हवा के साथ मिश्रय है।
- जल अन्य कई विलायकों के साथ एक एज़िओट्रोप बनाता है।
- जल को हाइड्रोजन और आक्सीजन में विद्युतपघटन द्वारा विभाजित किया जा सकता है।
- हाइड्रोजन की एक ऑक्साइड के रूप में, जब हाइड्रोजन या हाइड्रोजन-यौगिकों जलते हैं या ऑक्सीजन या ऑक्सीजन-यौगिकों के साथ प्रतिक्रिया करते हैं तब जल का सृजन होता है। जल एक ईंधन नहीं है। यह हाइड्रोजन के दहन का अंतिम उत्पाद है। जल को विद्युतपघटन द्वारा वापस हाइड्रोजन और आक्सीजन में विभाजन करने के लिए आवश्यक ऊर्जा, हाइड्रोजन और ऑक्सीजन को पुनर्संयोजन से उत्सर्जित ऊर्जा से अधिक होती है।
- वह तत्व जो हाइड्रोजन से अधिक वैद्युतधनात्मक (electropositive) होते हैं जैसे लिथियम, सोडियम,कैल्शियम, पोटेशियम और सीजयम, वो जल से हाइड्रोजन को विस्थापित कर हाइड्रोक्साइड (जलीयऑक्साइड) बनाते हैं। एक ज्वलनशील गैस होने के नाते, हाइड्रोजन का उत्सर्जन खतरनाक होता है और जल की इन वैद्युतधनात्मक तत्वों के साथ प्रतिक्रिया बहुत विस्फोटक होती है।
जल (पानी)
जल 

पानी सभी जीवों के लिए एक महत्वपूर्ण विलायक है
और पृथ्वी की सतह पर बहुतायत मे मिलने वाला यौगिक है।
सूचना एंव गुण साधारण नाम जल, पानी IUPAC नाम ऑक्सीडेन वैकल्पिक नाम एक्वा, डाईहाइड्रोजन मोनो ऑक्साइड,
हाइड्रोजन हाइड्रॉक्साइड, (और) अणु सूत्र H2O CAS संख्या 7732-18-5 InChI InChI=1/H2O/h1H2 मोलर द्रव्यमान 18.0153 g/mol घनत्व और रूप 0.998 g/cm³ (द्रव 20 °C पर, 1 atm)
0.917 g/cm³ (ठोस 0 °C पर, 1 atm) गलनांक 0 °C (273.15 K) (32 °F) क्वथनांक 99.974 °C (373.124 K) (211.95 °F) विशिष्ठ उष्मा क्षमता 4.184 J/(g·K) (द्रव 20 °C पर)
74.539 J/ (mol·K) (द्रव 25 °C पर) Supplementary data page Disclaimer and references

पानी सभी जीवों के लिए एक महत्वपूर्ण विलायक है
और पृथ्वी की सतह पर बहुतायत मे मिलने वाला यौगिक है।
हाइड्रोजन हाइड्रॉक्साइड, (और)
0.917 g/cm³ (ठोस 0 °C पर, 1 atm)
74.539 J/ (mol·K) (द्रव 25 °C पर)
संदर्भ
- ↑ Water Vapor in the Climate System, Special Report, [AGU], December 1995 (linked 4/2007). Vital Water UNEP.
- ↑ Kulshreshtha, S.N (1998). "[Scholar?hl=en&lr=&ie=UTF-8&sa=G&oi=qs&q=%2210.1023+a+1007957229865%22+author:s-kulshreshtha A Global Outlook for Water Resources to the Year 2025]". Water Resources Management 12 (3): 167–184.DOI:10.1023/A:1007957229865. Retrieved on 2008-06-09.
- ↑ Baroni, L.; Cenci, L.; Tettamanti, M.; Berati, M. (2007). "Evaluating the environmental impact of various dietary patterns combined with different food production systems". European Journal of Clinical Nutrition 61: 279–286. DOI:10.1038/sj.ejcn.1602522.
- ↑ Braun, Charles L.; Sergei N. Smirnov (1993). "Why is water blue?" (HTML). J. Chem. Educ. 70 (8): 612.
- ↑ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006)। Biology: Exploring Life। Boston, Massachusetts: Pearson Prentice Hall।
- ↑ Kotz, J. C., Treichel, P., & Weaver, G. C. (2005). Chemistry & Chemical Reactivity. Thomson Brooks/Cole.