आप पढ़ चुके हैं कि वायु गैसों का मिश्रण है और पर्यावरण का मुख्य अजैविक घटक है। वायु एक बहुत महत्त्वपूर्ण प्राकृतिक संसाधन है, जैसा कि सभी जीवित प्राणी वायु में साँस लेते हैं। मनुष्य एक दिन में लगभग 22,000 बार साँस लेता है और इस दौरान लगभग 16 किलोग्राम वायु उसके शरीर में प्रवेश करती है।
वायु की ही तरह, जल भी पर्यावरण का दूसरा अजैविक घटक है और सभी जीवित प्राणियों के लिये बहुत महत्त्वपूर्ण है। जल प्रचुर मात्रा में मिलने वाला और नवीकरणीय प्राकृतिक संसाधन है। पृथ्वी का लगभग तीन चौथाई भाग जल से ढका है। जल प्रकृति में स्वतंत्र अवस्था के साथ ही संयुक्त रूप में पाया जाता है। जल के अलग-अलग गुणधर्म इसे बहुत ही उपयोगी, महत्त्वपूर्ण और दैनिक जीवन के लिये आवश्यक बना देते हैं। हम इस पाठ में वायु और जल के विषय में पढ़ेंगे।
उद्देश्य
1. वायु के विभिन्न अवयवों की उनकी मात्रा के अनुसार तालिका बना सकेंगे ;
2. वायु के विभिन्न अवयवों (O2, N2, CO2) की महत्ता और उनके उपयोग को समझा सकेंगे एवं वायु दाब व हमारे लिये उसके उपयोग का संक्षिप्त विवरण दे सकेंगे;
3. वायु के विभिन्न प्रदूषकों, उनके विभिन्न उत्पन्न परिणामों एवं इन वायु प्रदूषकों के नियंत्रण के उपायों को सूचीबद्ध कर सकेंगे;
4. जल के विभिन्न स्रोतों की पहचान एवं उनके गुणों का उल्लेख कर सकेंगे;
5. पेय (पीने योग्य) एवं अपेय जल में अन्तर स्पष्ट कर सकेंगे एवं जल को पीने योग्य बनाने के लिये साधारण तरीकों की व्याख्या कर सकेंगे;
6. जल प्रदूषण के विभिन्न स्रोतों उनके द्वारा उत्पन्न परिणामों एवं जल प्रदूषण नियंत्रण के उपायों को वर्णित कर पाएँगे;
7. जल संरक्षण के महत्त्व एवं बारिश आधारित जल कृषि (संवर्धन) को मान्यता दे पाएँगे।
26.1 वायु का संघटन
प्राचीन दार्शनिक वायु को एक महत्त्वपूर्ण तत्व मानते थे। सन 1674 में मायो ने यह सिद्ध किया कि वायु तत्व नहीं है वरन दो पदार्थों का मिश्रण है जिनमें एक सक्रिय है व दूसरा निष्क्रिय। सन 1789 में लेवोसियर ने सक्रिय तत्व को ऑक्सीजन नाम दिया व कहा कि आयतन के अनुसार यह वायु का 1/5 वां भाग है जबकि निष्क्रिय तत्व को नाइट्रोजन कहा गया और आयतन के अनुसार वह वायु का लगभग 4/5 वां भाग है। वायु में ऑक्सीजन व नाइट्रोजन का अनुपात आयतन के अनुसार लगभग 1: 4 है।
वायु गैसों का एक मिश्रण है। समुद्र सतह पर शुष्क वायु का संघटन तालिका 26.1 में दिया गया है।
|
तालिका 26.1: वायु का संघटन |
|
|
गैसें |
संघटन (आयतन का प्रतिशत) |
|
नाइट्रोजन (N2) |
78.03 |
|
ऑक्सीजन (O2) |
20.09 |
|
ऑर्गन (Ar) |
0.94 |
|
कार्बन डाईऑक्साइड (CO2) |
0.033 |
|
अक्रिय गैसें (नियॉन, हीलियम, क्रिप्टॉन, ज़ीनान: Ne, He, Kr, Xe) |
0.0020 |
वायु में जल की मात्रा अलग-अलग स्थानों पर भिन्न होने के कारण तालिका में नहीं दी गई है।
ऊपर दी गई कौन सी गैसें निम्नांकित के लिये महत्त्वपूर्ण हैं:-
(क) प्रकाश संश्लेषण (ख) श्वसन
हाँ, आप सही हैं:- (क) कार्बन डाइऑक्साइड (ख) ऑक्सीजन
क्रियाकलाप 26.1
वायु में कार्बन डाइऑक्साइड के अध्ययन के लिये, आइए एक सामान्य क्रियाकलाप करते हैं।
उद्देश्यः- वायु में कार्बन डाइऑक्साइड की उपस्थिति दर्शाना।
आपको क्या चाहिए?
एक परखनली, कांच का गिलास, ताजा बना चूने का पानी, दो छेदों वाला कार्क, दो छेद किया हुआ थर्मोकोल का टुकड़ा, 90° के कोण पर मुड़ी हुई दो काँच की नलियां, सीधे कोण पर झुकी नलियां।
आपको क्या करना है?
1. परखनली कांच के गिलास में लगभग 4 ml ताज़ा बना चूने का पानी लें। परखनली गिलास के मुँह को कॉर्क / थर्माकोल (दो छेद वाला) से बंद कर दें, जिससे कि वे वायुरुद्ध हो जाएँ। आप वेसिलीन का प्रयोग कर सकते हैं।
2. कार्क के छिद्रों द्वारा परखनली में काँच की नलियां इस प्रकार डालें कि एक नली पानी में डूबी हो व दूसरी पानी की सतह से ऊपर रहे।
3. वह नली जो चूने के पानी से बाहर है, उससे परखनली की हवा को मुँह द्वारा बाहर खींच लें।
नोटः- रात भर पानी में भीगते चूने से स्वच्छ चूने का जल बनाया जा सकता है। चूने का पानी सुपरनेटेंट (प्लावी) है। वायु में कार्बन डाइऑक्साइड की उपस्थिति दर्शाने के लिये प्रयोगात्मक व्यवस्थापन आप क्या देखते हैं?
वायु में कार्बन डाइऑक्साइड की उपस्थिति दर्शाने के लिये प्रयोगात्मक व्यवस्थापन आप क्या देखते हैं?
परखनली में चूषण के कारण वायु दबाव गिर जाता है। परखनली में कम हुए दबाव को पूरा करने के लिये बाहर की हवा, चूने के पानी में डूबी हुई नली के द्वारा बुलबुलों के रूप में प्रवेश करती है।
आप देखेंगे कि एक मिनट बाद चूने का पानी दूधिया हो जाता है। क्या आप इसका कारण स्पष्ट कर सकते हैं? हाँ आप सही हैं। कार्बन डाइऑक्साइड ही चूने के पानी को दूधिया कर सकती है। क्या वायु में उपस्थित CO2 की अल्प मात्रा चूने के पानी को दूधिया करने में समर्थ है? कृपया अपने बड़ों/पुस्तकों की सहायता से ज्ञात करें।
पाठगत प्रश्न 26.1
1. एक रासायनिक पदार्थ तत्व, मिश्रण या यौगिक की तरह हो सकता है। इसमें वायु किस श्रेणी में आती है?
2. वायु के मुख्य संघटकों के नाम बताइए। पौधों और जानवरों के जीवनयापन के लिये कौन सा संघटक अनिवार्य है?
3. यदि आप पर्यावरण में नाइट्रोजन और ऑक्सीजन की परस्पर मात्रा की तुलना करें तो कौन सी मात्रा अन्य की तुलना में चार गुना है?
4. वायु में जल वाष्प भी होती है। लेकिन क्या सभी जगहों पर इसका प्रतिशत समान रहता है?
26.2 वायु के विभिन्न अवयवों का महत्त्व
ऑक्सीजन, नाइट्रोजन और कार्बन डाइऑक्साइड - मानव जाति, जन्तुओं और वनस्पति दोनों के लिये उपयोगी हैं। ऑक्सीजन और नाइट्रोजन के बिना जीवन असम्भव है। हमारे जीवन में जल वाष्प का भी बहुत महत्त्व है।
26.2.1 ऑक्सीजन
हम पृथ्वी पर रहते हैं, पृथ्वी वायु से घिरी है और वायु में ऑक्सीजन है। ऑक्सीजन वायु का एक मुख्य भाग, और ऑक्सीजन के बिना जीवन असम्भव है। ऑक्सीजन का महत्त्व और उपयोगिता इस प्रकार हैः-
(क) सामान्य उपयोग
i. ऑक्सीजन लगभग सभी जीवों में श्वसन के लिये अति आवश्यक है।
ii. यह दहन में सहायक है और ऑक्सीजन की उपस्थिति में पदार्थ आसानी से जलते हैं।
iii. द्रव ऑक्सीजन का रॉकेट-ईंधन के उपचायक के रूप में प्रयोग होता है जिसे द्रव उपचायक (Liquid Oxidant, LOX) कहते हैं।
iv. वायु ऑक्सीजन जल में घुल जाती है जो जीवों के लिये श्वसन का स्रोत है।
v. अधिक ऊँचाई पर पर्वतारोहण के समय पर्वतारोहियों द्वारा अधिक ऊँचाई पर उड़ान के समय और ऑक्सीजन सिलेण्डर इस्तेमाल किए जाते हैं तथा अग्निशमन के दौरान अग्निशामकों द्वारा की जाती है।
vi. लोहे पर जंग ऑक्सीजन और जल की उपस्थिति में लगती है।
(ख) चिकित्सा में उपयोग
1. यह दमा के रोगियों या गैस विषाक्तीकरण ऑक्सीजन और अस्पतालों में कृत्रिम श्वसन के लिये ऑक्सीजन का उपयोग किया जाता है।
2. ऑक्सीजन और नाइट्रस ऑक्साइड के मिश्रण को शल्य क्रिया में निश्चेतक के रूप में प्रयोग किया जाता है।
(ग) औद्योगिक उपयोग
इस्पात उद्योग में:- लोहे में उपस्थित अशुद्धियाँ ऑक्सीजन की उपस्थिति में जलाकर दूर की जाती है।
काटने और वेल्डिंग (Welding) के लियेः- ऑक्सीजन को हाइड्रोजन (हाइड्रोजन टॉर्च में) या ऐसीटिलीन (ऑक्सी ऐसीटिलीन टार्च में) के साथ मिलाया जाता है। यह मिश्रण बहुत अधिक तापमान उत्पन्न करने के लिये जलाया जाता है एवं धातुओं को काटने एवं वेल्डिंग के लिये उपयोग किया जाता है।
सल्फ़र से सल्फ़्यूरिक अम्ल और अमोनिया (NH3) से नाइट्रिक अम्ल के उत्पादन में भी ऑक्सीजन का उपयोग किया जाता है।
ऑक्सीजन के हानिकारक प्रभाव
1. संक्षारण का अर्थ है कि वैद्युत रासायनिक प्रक्रिया द्वारा किसी धातु का ह्रास होना है। संक्षारण का सबसे साधारण सा उदाहरण लोहे में ज़ंग लगना है। ऑक्सीजन गैस और पानी की उपस्थिति के कारण लोहे में ज़ंग लग जाती है। ठीक उसी प्रकार अन्य दूसरी धातुएँ जैसे ऐल्युमिनीयम और तांबा भी ऑक्सीजन की उपस्थिति के कारण धीरे-धीरे संक्षारित हो जाते हैं। क्या आप ऐसे किन्हीं जो ज़ंग लगे आइटमों (वस्तुओं) की सूची बना सकते हैं जिन्हें आपने देखा हो। दिये गये स्थान में आप उनके नाम लिखिए।
2. ऑक्सीजन अधिकतर सभी तत्वों के साथ मिलकर ऑक्साइड बनाती हैं।
26.2.2 नाइट्रोजन
नाइट्रोजन प्रोटीन का मुख्य संघटक है। अनेक ऐमीनो अम्ल जिनमें नाइट्रोजन होती है, मिलकर प्रोटीन बनाते हैं। प्रोटीन से शरीर बनता है। शरीर की विभिन्न जैवरासायनिक क्रियाओं में जो एन्ज़ाइम उत्प्रेरक का कार्य करते हैं, उनमें से अधिकांश प्रोटीन होते हैं। नाइट्रोजन के मुख्य उपयोग इस प्रकार हैं:-
1. नाइट्रोजन ऑक्सीजन की क्रियाशीलता को कम करता है। यदि वायु में ऑक्सीजन की मात्रा को बढ़ा दिया जाए तो उपापचय, दहन और संक्षारण जैसे प्रक्रम बहुत तेज़ और नुकसानदायक हो जाएँगे। नाइट्रोजन की उपस्थिति के कारण भोजन का ऑक्सीकरण और ईंधन के दहन की दर संयत (धीमे) हो जाती है।
2. नाइट्रोजन यौगिक, वनस्पति के लिये बहुत महत्त्वपूर्ण है क्योंकि ये प्रोटीन उत्पादन में सहायक होते हैं। मानव एवं जन्तु पौधों से ही प्रोटीन प्राप्त करते हैं। प्रोटीन के कार्यों को याद करें और बढ़ते बच्चों में प्रोटीन की कमी से होने वाली बीमारी का नाम बताएँ।
26.2.3 कार्बन डाइऑक्साइड
वायु में कार्बन डाइऑक्साइड का प्रतिशत एक स्थान से दूसरे स्थान पर परिवर्तनशील है। मनुष्य की कौन सी दो ऐसे क्रियाकलाप हैं जो वायुमंडलीय कार्बन डाइऑक्साइड बढ़ने के लिये जिम्मेदार हैं।
कार्बन डाइऑक्साइड के मुख्य उपयोग हैं:-
1. प्रकाश संश्लेषण के दौरान, पौधे वायु से कार्बन डाइऑक्साइड और जलवाष्प को क्लोरोफिल और प्रकाश की उपस्थिति में ग्लूकोज़ में परिवर्तित कर देते हैं।
2. कार्बन डाइऑक्साइड जल में घुलकर कॉर्बनिक एसिड H2CO3 बनाती है जो चट्टानों में मौजूद कैल्सियम कार्बोनेट (CaCO3 ), मैग्नीशियम कार्बोनेट (MgCO3) से मिलकर Ca(HCO3) और Mg(HCO3) बनाती है। ये लवण पानी को उसका प्राकृतिक जल और भूमि व पौधों को Ca2+, Mg2+ (कैल्शियम, मैग्नीशियम) आयन प्रदान करते हैं, जो उनकी वृद्धि के लिये आवश्यक हैं।
3. यह खाद्य परिरक्षण में भी काम आती है। जब अनाज को वातावरणीय कार्बन डाइऑक्साइड के साथ भण्डारित करते हैं तो कीड़े अनाज को नुकसान नहीं पहुँचा पाते। क्या आप इसका कारण बता सकते हैं।
4. ठोस CO2 शुष्क बर्फ (Dry ice) कहलाती है और यह प्रशीतक की तरह इस्तेमाल होती है।
6. पानी में घुलनशील होने के कारण यह मृदु या कार्बोनेटिड पेय (Carbonated drinks) बनाने के काम आती है। जब हम शीतल पेय की बोतल खोलते हैं तो जो बुदबुदाहट बाहर आती है, वह कार्बन डाइऑक्साइड होती है।
7. यह अग्निशामकों में अग्निशमन के लिये इस्तेमाल की जाती है।
कार्बन डाइऑक्साइड के हानिकारक प्रभाव
कार्बन डाइऑक्साइड एक ग्रीन हाउस गैस है। यह अवरक्त विकिरण (इन्फ्रारेड रेडिएशन) को रोक लेती है और इसका परिणाम भौगोलिक तापन के रूप में दिखाई देता है।
26.2.4 वाष्पन
हम जानते हैं कि वायु में जलवाष्प होती हैं। वायु में इसकी मात्रा सब जगह समान नहीं होती। यह समुद्र के ऊपर और निम्न अक्षांश पर अधिकतम होती है और भूमि और ध्रुवीय क्षेत्रों में वाष्प की मात्रा कम होती है। यह सर्दी की अपेक्षा ग्रीष्म ऋतु में अधिक होती है।
यद्यपि जल वाष्प वायुमण्डल का बहुत छोटा भाग होता है परंतु यह वातावरण के तापन एवं शीतलन में और दैनिक मौसम के बदलाव में यह प्रमुख भूमिका निभाते हैं। वास्तव में बादल, वर्षा, कोहरा, हिमपात, पाला और ओस जो भी हम अनुभव करते हैं, सभी वातावरण में उपस्थिति का परिणाम है।
परन्तु वायुमण्डल में जलवाष्प आते कहाँ से हैं? यह वातावरण में वाष्पन के कारण आते हैं। वाष्पन वह प्रक्रम है जिसमें किसी भी स्रोत का पानी ‘ऊष्मा के कारण’ वाष्प में बदल जाता है। पानी के स्रोत से सूर्य की ऊष्मा के कारण जल वाष्पित होकर बादल बनाता है और तब संघनित होकर वर्षा करता है।
बादलों का बनना
वायुमण्डल में जल वाष्प के संघनन से बादल बनते हैं। नमी वाली हवा ऊपर उठते हुए ठण्डी होती जाती है और फि़र बादल बनाती है। जब ओस बिन्दु के पहुँच जाने पर वाष्प संघनन द्वारा छोटे-छोटे जल बिन्दुक या हिम स्फटक (Snow crystals) बन जाती है और ये वायु में विद्यमान धूल कणों पर चिपक जाती है। ऐसे करोड़ों सूक्ष्म जल बिन्दुक और हिम स्फ़टक गिरने के बजाए हवा में तैरते रहते हैं। ये हवा के साथ बादलों के रूप में उड़ते रहते हैं। आकार और ऊँचाई के अनुसार बादल विभिन्न प्रकार के होते हैं। यदि आप आसमान को ध्यान से देखें तो आप देखेंगे कि बादल विभिन्न प्रकार के होते हैं।
ओस बिन्दु (Dew point): वह तापमान जिस पर वाष्प, संघनन के बाद जल की बूँद में परिवर्तित हो जाती है
वर्षा
जब बादल ऊपर उठने से ठण्डे होते जाते हैं या वे वायुमण्डल के ठण्डे क्षेत्र में पहुँच जाते हैं तो जल बिन्दुक और भी ठण्डे होकर पास-पास आ जाते हैं। कई बिन्दुक मिलकर पानी की बूँद बनाते हैं। ये बूँदें इतनी बड़ी हो जाती हैं कि ये हवा में तैर नहीं पातीं और बारिश नीचे पृथ्वी पर गिर जाती हैं। जैसे-जैसे ये नीचे आती हैं, ये अन्य बिन्दुकों को अपने साथ मिलाती जाती हैं। बादलों से इन बड़ी बूँदों के गिरने को वर्षा कहते हैं। यह प्रक्रम अवक्षेपण कहलाता है। वर्षा मापने के यंत्र को वर्षा मापक (Rain gauze) कहते हैं। वर्षा से.मी. में मापी जाती है।
|
क्या आप जानते हैं सबसे अधिक वर्षा भूमध्य रेखा के पास के देशों और दक्षिण-पूर्वी एशिया में होती है। इन क्षेत्रों में वार्षिक वर्षा 200 cm या अधिक होती है। सबसे कम वर्षा टुंड्रा प्रदेश, मध्य एशिया और रेगिस्तानों में होती है, जहाँ यह 25 cm या उससे भी कम होती है। 20-200 सेमी. के बीच की मध्यम वर्षा, पश्चिमी यूरोपीय देशों, टैगा क्षेत्रों और चीन में होती है। |
26.2.5 आपेक्षिक आर्द्रता हाग्रोमीटर वायुमण्डल में जल वाष्प की उपस्थिति को आर्द्रता (Humidity) के नाम से जाना जाता है। वायु की आर्द्रता ताप से सम्बन्धित होती है। जैसे गर्मियों में आपने देखा होगा - किसी-किसी दिन तापमान और आर्द्रता दोनों ही अधिक होते हैं।
हाग्रोमीटर वायुमण्डल में जल वाष्प की उपस्थिति को आर्द्रता (Humidity) के नाम से जाना जाता है। वायु की आर्द्रता ताप से सम्बन्धित होती है। जैसे गर्मियों में आपने देखा होगा - किसी-किसी दिन तापमान और आर्द्रता दोनों ही अधिक होते हैं।
कमरे के तापमान पर वायु के एक आयतन में उपस्थित जल वाष्प की संहति और उसी तापमान पर वायु के उसी आयतन को संतृप्त करने के लिये आवश्यक वाष्प की संहति के अनुपात को आपेक्षिक आर्द्रता कहते हैं।
आर्द्रता को मापने वाले यंत्र को आर्द्रतामापी (हाइग्रोमीटर) कहते हैं।
आपेक्षिक आर्द्रता का वर्णन करते समय, तापमान का उल्लेख करना आवश्यक है। आपेक्षिक आर्द्रता को नापने का यंत्र हाइग्रोमीटर कहलाता है।
पाठगत प्रश्न 26.2
1. जीवन के लिये ऑक्सीजन क्यों अनिवार्य है? यदि वायु में ऑक्सीजन न हो तो क्या होगा?
2. कार्बन डाइऑक्साइड पौधों के लिये भोजन का कार्य करती है। उस प्रक्रिया का नाम बताएँ जिसमें यह भोजन बनाने में प्रयुक्त होती है।
3. शुष्क बर्फ क्या है और यह किस लिये उपयोग में आती है?
4. यदि आपने सभी प्रकार के प्रोटीन का विश्लेषण किया है, आपने एक ख़ास तत्व सभी में समान रूप से पाया होगा, वह तत्व कौन सा है?
26.2.6 वायु और उसका दाब
हम जानते हैं कि वायु गैसों का मिश्रण है और गुरूत्वाकर्षण के कारण इन गैस के कणों का कुछ भार है। कोई भी वस्तु जिसमें भार है, दूसरी वस्तु पर दबाव डालती है। वायु का आवरण जो पृथ्वी (वायुमंडल) को घेरता है, एक बल पैदा करता है जो पृथ्वी की सतह पर नीचे की तरफ़ काम करता है।
किसी सतह के प्रति इकाई क्षेत्रफ़ल पर लगने वाला हवा के कॉलम का बल वायुमण्डल के दबाव का परिणाम होता है। यह दबाव वायुमण्डलीय दाब कहलाता है। वायुमण्डलीय दबाव लगभग 1 kg cm-2 या 10 ton m-2 होता है।
क्रिया कलाप 26.2
उद्देश्यः यह प्रदर्शित करना कि वायु दबाव डालती है।
क्या आवश्यक है?
मिनरल वॉटर की एक खाली पॉलिथीन की बोतल और कुछ गर्म पानी क्या करता है?
i. मिनरल वॉटर की एक खाली बोतल लें।
ii. उसमें कुछ गर्म पानी भर लें और उसे वायुरुद्ध) बनाने के उद्देश्य से उसका ढक्कन कस कर बंद कर दें।
iii. बोतल पर ठण्डा पानी गिराएँ।
आपने क्या निरीक्षण किया?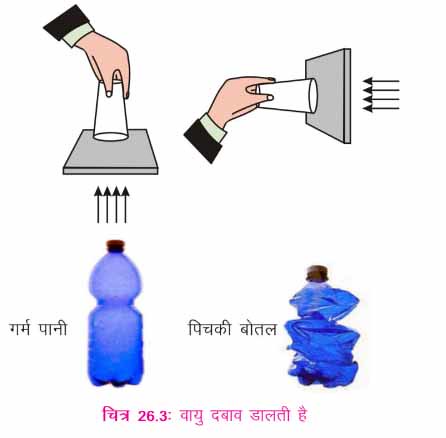 वायु दबाव डालती है आप देखेंगे कि बोतल टूट जाती है और विकृत हो जाती है जब बोतल के अंदर जल वाष्प ठण्डी होकर जल में संघनित हो जाती है।
वायु दबाव डालती है आप देखेंगे कि बोतल टूट जाती है और विकृत हो जाती है जब बोतल के अंदर जल वाष्प ठण्डी होकर जल में संघनित हो जाती है।
ऐसा क्यों होता है?
जब एक खाली बोतल में गर्म पानी लिया जाता है, उसमें उपस्थित वायु गर्म होकर फ़ैलती है। उसमें से कुछ वायु बाहर भी जाती है। ठण्डा होने पर बंद बोतल के अंदर वायु संकुचित होती है। इससे बोतल के अंदर आंशिक निर्वात उत्पन्न होता है। बाहर का वायुमण्डलीय दबाव बोतल पर दबाव बनाता है और इस कारण से बोतल टूट जाती है। यह दर्शाता है कि वायु दबाव बनाती है।
हमारे दैनिक जीवन में, कई चीज़ों के काम करने में वायुमण्डलीय दबाव एक महत्त्वपूर्ण भूमिका निभाता है, उदाहरण के तौर पर, स्ट्रा का कार्य करना, सीरिंज या इंक ड्रॉपर का कार्य, पानी के पम्प का कार्य आदि। सोचें और स्पष्ट करने का प्रयास करें कि वायुमण्डलीय दबाव ऊपर दिए गए उपकरणों के कार्य करने में किस तरह सहायक है?
26.2.7 वायु दाब में ऊँचाई के साथ परिवर्तन
अन्य पदार्थों की तरह वायुमण्डलीय गैसों के अणु और परमाणुओं पर पृथ्वी के गुरूत्वाकर्षण दबाव का प्रभाव होता है। इसके कारण ऊँचाई के मुक़ाबले पृथ्वी की सतह के पास का वायुमण्डल अधिक घना होता है। जैसे-जैसे हम पृथ्वी से ऊपर जाते हैं, वायु का घनत्व बहुत तेज़ी से कम होता है। अतः ऊँचाई के साथ वायुमण्डलीय दाब कम होता जाता है। अक्सर अधिक ऊँचाई पर लोगों की नाक से ख़ून आने लगता है क्योंकि बाहर के दाब (वायुमण्डलीय दाब) की अपेक्षा रक्तचाप बहुत अधिक हो जाता है।
वायु के दबाव के नापने के लिये प्रयुक्त उपकरण बैरोमीटर कहलाता है।
26.2.8 वायुमण्डल वायुमंडल की परतें पृथ्वी को चारों ओर से घेरे हुए उपस्थित वायु के क्षेत्र को वायुमण्डल कहते हैं। वायुमंडल हमें और अन्य सभी जीवों को हानिकारक विकिरणों जैसे पराबैंगनी किरणों से बचाता है। ताप संघटन और दाब परिवर्तन के आधार पर हम वायुमण्डल को विभिन्न परतों में विभाजित कर सकते हैं। पृथ्वी की सतह से 0-10 km ऊपर तक ट्रोपोस्फि़यर (troposphere), 10-50 km ऊपर तक स्ट्रेटोस्फ़ीयर (Startosphere), 50-58 km की ऊँचाई तक मीज़ोस्फि़यर (Mesosphere), और 85-500 km तक थर्मोस्फि़यर (Thermosphere) होते हैं।
वायुमंडल की परतें पृथ्वी को चारों ओर से घेरे हुए उपस्थित वायु के क्षेत्र को वायुमण्डल कहते हैं। वायुमंडल हमें और अन्य सभी जीवों को हानिकारक विकिरणों जैसे पराबैंगनी किरणों से बचाता है। ताप संघटन और दाब परिवर्तन के आधार पर हम वायुमण्डल को विभिन्न परतों में विभाजित कर सकते हैं। पृथ्वी की सतह से 0-10 km ऊपर तक ट्रोपोस्फि़यर (troposphere), 10-50 km ऊपर तक स्ट्रेटोस्फ़ीयर (Startosphere), 50-58 km की ऊँचाई तक मीज़ोस्फि़यर (Mesosphere), और 85-500 km तक थर्मोस्फि़यर (Thermosphere) होते हैं।
वायुमण्डल का सबसे क्रियाशील क्षेत्र ट्रोपोस्फि़यर है, यहाँ वायु की कुल संहति का 18 % भाग और वायुमण्डल का अधिकतम जल वाष्प पाया जाता है। यह वायुमण्डल की सबसे पतली परत है और मौसम बदलाव की सभी घटनाएँ (वर्षा आदि) इसी परत पर होते हैं।
26.3 वायु प्रदूषण
आपने भारी वाहनों के ट्रैफि़क वाले क्षेत्रों में उगने वाले पौधों पर काले काजल का जमाव अवश्य देखा होगा। क्या आपने कभी सोचा है कि ऐसा क्यों होता है? यह वायु में उपस्थित प्रदूषकों के कारण हैं। ये प्रदूषक वायु प्रदूषण के कारणों में शामिल हैं। वायु प्रदूषण वातावरण में ज़हरीले रसायनों, जैविक कचरे और विषाक्त पदार्थों के पहुँचने से होता है। प्रदूषण का दुष्प्रभाव मानव के साथ ही सभी अन्य जीवधारियों पर पड़ता है।
प्रदूषकों को दो मुख्य श्रेणियों में बाँटा जा सकता हैः
(क) प्राथमिक प्रदूषक जो कि वातावरण में सीधे छोड़े जाते हैं जैसे मोटर वाहनों से निकलने वाली कार्बन डाइऑक्साइड।
(ख) द्वितीयक प्रदूषक जो कि वातावरण में सीधे नहीं जाते बल्कि प्राथमिक प्रदूषणों की क्रियाओं से वायु में बनते हैं।
मुख्य प्राथमिक प्रदूषकों में शामिल हैं:-
कार्बन मोनोक्साइड (CO) ईंधन के अपूर्ण दहन से बनती है जैसे पैट्रोल, प्राकृतिक गैस, कोयला और लकड़ी। यह रंगहीन एवं गंधहीन है लेकिन अत्यंत ज़हरीली प्रकृति की है।
कार्बन डाईऑक्साइड (CO2) मोटर वाहनों एवं विभिन्न उद्योगों में ईंधन के पूर्व दहन से बनती है। यह एक रंगहीन, गंधहीन एवं अघातक गैस है। (एक व्यक्ति की मृत्यु कार्बन डाइ ऑक्साइड के वायुमण्डल में ऑक्सीजन की कमी के कारण होती है, न कि इसकी ज़हरीली प्रकृति के कारण)।
सल्फ़र ऑक्साइड (SOx) (मुख्यतः सल्फ़र डाई ऑक्साइड (SO2) कोयले और पैट्रोलियम के दहन से उत्पन्न होती है और ज्वालामुखियों में भी पैदा होती है)।
यह विभिन्न औद्योगिक प्रक्रियाओं में भी उत्पन्न होती है। सल्फ़र डाइ ऑक्साइड (SO2) के सल्फ़र डाइ ऑक्साइड (SO3) में ऑक्सीकरण के फ़लस्वरूप सल्फ्यूरिक एसिड (H2SO4) का निर्माण होता है, जो अम्लीय वर्षा (एसिड रेन) का कारण है।
नाइट्रोजन ऑक्साइड (NOx) मुख्यतः नाइट्रोजन डाइऑक्साइड (NO2) एक लाल- भूरे रंग की तीक्ष्ण गंधयुक्त गैस है। यह SO2 से SO3 के ऑक्सीकरण को उत्प्रेरित करती है और अपरोक्ष रूप से अम्लीय वर्षा का कारण बनती है।
कणिकीय कार्बनिक यौगिक (VOC) में मीथेन, बेन्ज़ीन, टॉल्यूईन, और ज़ाईलीन शामिल हैं। जहाँ मीथेन एक प्रमुख ग्रीन हाउस गैस है, अन्य को कैंसरजन (कैंसर का कारण) माना जाता है।
कणिकीय पदार्थों (पर्टिकुलेट मैटर) में वायु में फ़ैले ठोस या द्रवों के छोटे कण शामिल होते हैं। ये निलंबित कणिकीय पदार्थ (सस्पेण्डिड पर्टिकुलेट मैटर – एस.पी.एम.) कहलाते हैं। इनके मुख्य स्रोतों में शामिल हैं ज्वालामुखी, धूल भरे तूफान और ईंधन का दहन। इनसे हृदय व फ़फ़ेड़ों संबंधी रोग एवं श्वसन के रोग होते हैं।
क्लोरो फ़्लोरो कार्बन (CFC) का प्रयोग एयर कंडीशनर एवं फ्रिज में प्रशीतक के तौर पर किया जाता है, जो ओज़ोन पर्त के लिये हानिकारक हैं जो कि हमें घातक अवरक्त किरणों से बचाती है।
मुख्य द्वितीयक प्रदूषकों में शामिल हैं:
फ़ोटोकैमिकल धूम कोहरा (स्मोग) (धुआँ+कोहरा) वातावरण में SO2 के साथ कोयले एवं पैट्रोल के दहन के कारण बनने वाले कणिकीय पदार्थ पर सूर्य के अवरक्त प्रकाश की क्रिया के कारण बनता है। यह प्रदूषकों का छितराव रोकता है और श्वसन संबंधी बीमारियाँ रोकता है।
भूतल ओज़ोन (O3) NOx और VOC से बनती है। यह धूम-कोहरे का संघटक है। सामान्यतः ओज़ोन स्ट्रेटोस्फि़यर में पाई जाती है और अवरक्त विकिरण की पृथ्वी तक पहुँचने से रोकती है। भूतल पर जब श्वसन द्वारा शरीर के अंदर जाती है तो यह मनुष्यों एवं जानवरों के स्वास्थ्य के लिये खतरा बनती है।
पाठगत प्रश्न 26.3
1. जब हम पर्वत पर चढ़ाई करते हैं तो वायुमण्डलीय दबाव के साथ क्या होता है?
2. अधिक ऊँचाई वाले स्थानों पर लोगों की नाक से ख़ून आने लगता है। क्यों?
3. वायुमण्डल की कौन सी पर्त पृथ्वी की सतह के सबसे निकट है और कौन सी पर्त पृथ्वी की सतह से सबसे दूर है?
4. वायुमण्डल की कौन सी पर्त में ओज़ोन पर्त पाई जाती है?
5. निम्नांकित का नाम दीजिएः
(i) एक ग्रीन हाउस गैस (ii) अम्लीय वर्षा के लिये जिम्मेदार गैस (iii) ओज़ोन छिद्र के लिये जिम्मेदार रसायन
26.4 जल-इसके स्रोत एवं गुणधर्म
जीवधारियों के लिये, हवा के अतिरिक्त सबसे महत्त्वपूर्ण पदार्थ जल है। जीवधारी जल के बिना अधिक समय तक जीवित नहीं रह सकते। पृथ्वी पर जल पर्याप्त मात्रा में उपलब्ध है। पृथ्वी की सतह पर समुद्रों, नदियों और झीलों में तीन-चौथाई से अधिक जल है। यह पृथ्वी के भूपटल के अंदर भी मिलता है। हमें कुओं से मिलने वाला अधिकतर जल इसी स्रोत से प्राप्त होता है।
26.4.1 जल के स्रोत
वर्षा, झील, कुएँ, नदियाँ और समुद्र जल के प्राकृतिक स्रोत हैं।
(क) वर्षा का जल- वर्षा के जल में अशुद्धता न होने के कारण इसे प्राकृतिक जल का सबसे शुद्ध रूप माना जाता है। हम जानते हैं कि सूर्य की गर्मी से समुद्र और नदियों का पानी वाष्पित होकर जल से वाष्प बन जाता है वाष्पीकरण की इस प्रक्रिया के दौरान जल की अशुद्धियाँ नीचे रह जाती हैं। जल-वाष्प वायुमण्डल में ऊपर जाकर संघनन द्वारा बादल बनाती है। जल की बूँदे वर्षा के रूप में नीचे गिरती हैं।
(ख) स्रोतों का जल- वर्षा के जल का मृदा में रिसाव होने से स्रोत बनता है। स्रोतों जैसे कुओं और झील के जल की आपूर्ति होती है।
(ग) कुएँ का जल- वर्षा का जल मृदा में रिसने पर नीचे चला जाता है और पत्थरों या कठोर भूपटल पर एकत्र हो जाता है। कुएँ खोदने पर भूमिगत जल हमें उपलब्ध हो जाता है। इसे कुएँ का जल कहते हैं। यह जल शुद्ध नहीं भी हो सकता है। यह निलंबित कणों, जीवाणुओं और अन्य सूक्ष्मजीवों के कारण अशुद्ध हो सकता है।
(घ) नदी का जल- पहाड़ों की बर्फ पिघलने से तथा कभी-कभी वर्षा के पानी से नदियाँ बनती हैं। यह जल भी शुद्ध न होने के कारण पीने लायक़ नहीं होता।
(ड.) समुद्र का जल- इन स्रोतों में से समुद्र का जल, जल के प्राकृतिक स्रोतों में सबसे बड़ा है। फि़र भी यह साधारण नमक एवं अन्य रसायनों का स्रोत है। यह जल का सबसे अशुद्ध रूप है। नदियों के जल में घुली सभी अशुद्धियाँ उच्च लवणीयता और अन्य अशुद्धियों के कारण समुद्र का पानी सीधे पीने योग्य नहीं होता।
26.4.2 पीने योग्य एवं अपेय जल
पेय या पीने योग्य जल से तात्पर्य ऐसे जल से है जो मनुष्यों व अन्य जानवरों के लिये पीने योग्य हो। यह त्वरित या दीर्घावधि नुकसान की न्यूनतम संभावनाओं के साथ लिया जा सकता है इसमें बीमारी पनपाने वाले सूक्ष्म जीव, घुले हुए लवणों का उच्च स्तर एवं पोषक तत्व, भारी-धातुएँ एवं निलंबित ठोस पदार्थ हो सकते हैं। इस प्रकार के पानी को पीना या इससे खाना पकाना बीमारी का कारण बनता है और इससे मृत्यु भी हो सकती है। संक्रमित या अपेय जल का शुद्धिकरण कर के पीने योग्य या पेय जल बनाया जा सकता है। आइए जल के शुद्धिकरण के सामान्य तरीक़े सीखते हैं।
26.4.3 जल को पीने योग्य बनाने के लिये इसका शुद्धिकरण
निस्तारण या निथार कर अघुलनशील अशुद्धियाँ दूर की जा सकती हैं। निस्तारण पृथक्करण की वह प्रक्रिया है जिसमें ठोस पदार्थ सतह पर नीचे एकत्र हो जाते हैं एवं द्रव को छान कर अलग कर लिया जाता है। जल को एक पात्र में कुछ समय के लिये रखना होता है। निलंबित अघुलनशील ठोस पदार्थ सतह पर जमा हो जाते हैं। स्वच्छ जल को सावधानी के साथ छान कर अलग पात्र में एकत्र कर लिया जाता है। इस प्रक्रिया में यह ध्यान रखते हैं कि सतह पर जमा ठोस पदार्थ में हलचल न हो। लेकिन इस प्रकार प्राप्त जल को अन्य शुद्धीकरण द्वारा पीने योग्य बनाना होता है।
फि़ल्टर करके या छान कर भी अघुलनशील अशुद्धियाँ दूर की जा सकती है। यह निस्तारण से प्रभावी तरीका है और अघुलनशील अशुद्धियों के बहुत छोटे कणों को भी दूर कर देता है। इसमें कपड़े का एक टुकड़ा एक सस्ते व आसानी से उपलब्ध फि़ल्टर की तरह इस्तेमाल होता है। जब इसमें से पानी छाना जाता है, तब अघुलनशील अशुद्धियाँ फि़ल्टर द्वारा रोक ली जाती है और इसमें से शुद्ध जल अलग हो जाता है।
साधारणतः उपलब्ध जल फि़ल्टर में कैण्डल का उपयोग होता है जो छिद्रयुक्त पदार्थ के बने होते हैं। शुद्ध जल इसमें से गुजरता है और अशुद्धियाँ कैण्डल की बाहरी सतह पर रह जाती हैं। कैण्डल को समय-समय पर साफ़ करते रहना चाहिए ताकि ये प्रभावी बनी रहें। कैंडल i. उबाल कर जल के बैक्टीरिया व अन्य जीवाणु मर जाते हैं। जब उबले हुए जल को ठण्डा किया जाता है तो भारी अशुद्धियाँ तल पर बैठ जाती हैं और जल में घुला हुआ नमक सतह पर पतली सी परत के रूप में जम जाता है जिसे झाग (Scum स्कम) कहते हैं। अब यदि हम पानी को छानते हैं तो पानी पीने के लिये सुरक्षित होता है।
कैंडल i. उबाल कर जल के बैक्टीरिया व अन्य जीवाणु मर जाते हैं। जब उबले हुए जल को ठण्डा किया जाता है तो भारी अशुद्धियाँ तल पर बैठ जाती हैं और जल में घुला हुआ नमक सतह पर पतली सी परत के रूप में जम जाता है जिसे झाग (Scum स्कम) कहते हैं। अब यदि हम पानी को छानते हैं तो पानी पीने के लिये सुरक्षित होता है।
क्लोनीकरण द्वारा जल में उपस्थित सूक्ष्म जीव एवं बैक्टीरिया आदि मर जाते हैं यदि आवश्यकता होती है तो शुद्धिकृत जल को छाना जाता है ताकि अघुलनशील अशुद्धियाँ दूर हो सकें।
26.4.4 जल के गुणधर्म
जल, जो हमें सामान्य साधारण पदार्थ प्रतीत होता है वास्तव में अत्यधिक असाधारण पदार्थ है जिसमें अनेक विशेष गुणधर्म विद्यमान है जो इसे हमारे प्रतिदिन के जीवन के लिये महत्त्वपूर्ण और आवश्यक बनाते हैं।
26.4.4 (क) जल-सार्वत्रिक विलायक के रूप में
जल निश्चित ही सबसे उत्तम और अति आवश्यक विलायकों में से एक है। इसका विशेष गुण यह है कि इसमें बहुत सारे पदार्थ-ठोस पदार्थ जैसे नमक और चीनी से लेकर गैसीय पदार्थ जैसे ऑक्सीजन, कार्बन डाइऑक्साइड आदि घुल जाते हैं। वास्तव में, जल में इतने अधिक पदार्थ घुल जाते हैं कि इसे सार्वत्रिक विलायक कहते हैं। जल का यह गुण पौधों को मिट्टी से भोजन और खनिज तत्व लेने में सहायता करता है। हम जो खाना खाते हैं, उसे जल विलयन के रूप में आत्मसात करने में सहायता करता है। अनेक रासायनिक अभिक्रियाएँ केवल जलीय विलयनों में होती हैं।
26.4.4 ख कठोर जल और मृदु जल
जल साबुन के साथ झाग बनाता है जिसका इस्तेमाल सफ़ाई के लिये किया जाता है, यह मृदु जल कहलाता है। कभी-कभी जल के अन्य स्रोतों जैसे नदी और हैंडपम्प के जल से साबुन में झाग नहीं बनता। इसे कठोर जल कहते हैं।
नल से प्राप्त जल में घुले हुए लवणों की मात्रा, हैंडपंप के जल की तुलना में कम होती है। जल में घुले लवण प्रायः कैल्शियम और मैग्नीशियम बाइकार्बोनेट, सल्फ़ेट तथा क्लोराइड होते हैं। यह लवण झाग को बनने से रोकते हैं, परन्तु क्यों?
साबुन एक सोडियम लवण है जिसे सोडियम स्टिऐरेट कहते हैं। यह जल में घुलनशील होता है। अतः कठोर जल जिसमें कैल्शियम और मैग्नीशियम के आयन होते हैं, साबुन के साथ मिलकर Ca या Mg स्टिऐरेट के अवक्षेप बनाता है जो चिकने स्कम (greasy scum) होते हैं। स्कम के बनने से झाग नहीं बनता और सफ़ाई भी मुश्किल हो जाती है।
सोडियम स्टीएरेट + कैल्शियम सल्फ़ेट → कैल्शियम स्टीऐरेट + सोडियम सल्फ़ेट
(साबुन)/(स्कम)
अतः हम कह सकते हैं कि
i. वह जल जो साबुन के साथ झाग बनाता है, मृदु जल कहलाता है।
ii. वह जल जो साबुन के साथ झाग नहीं बनाता, कठोर जल कहलाता है।
iii. जल की कठोरता जल में उपस्थित मैग्नीशियम और कैल्शियम के लवणों के कारण होती है।
26.4.4 (ग) कठोर जल का मृदु जल में परिवर्तन
कठोर जल साबुन के साथ झाग नहीं बनाता। क्या हम इस कठोर जल को मृदु जल में परिवर्तित कर सकते हैं? हाँ, जल की कठोरता के लिये उत्तरदायी कैल्शियम और मैग्नीशियम आयनों को हटाकर यह प्रक्रिया जल का मृदुकरण कहलाती है।
जल की कठोरता दो प्रकार की होती है-
i. अस्थायी कठोरता
ii. स्थायी कठोरता
(क) अस्थायी कठोरता
जल की अस्थायी कठोरता Temporary hardness) जल में घुलनशील कैल्शियम और मैग्नीशियम के बाइकार्बोनेट की उपस्थिति के कारण होती है। इसे कार्बोनेट की कठोरता भी कहते हैं। इसे उबाल कर या धावन सोडा जैसे रसायनों के साथ अभिक्रिया करके दूर किया जा सकता है।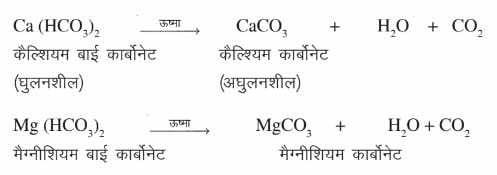 समीकरण (i) उबालनाः कठोर जल के उबालने पर उसमें उपस्थित कैल्शियम और मैग्नीशियम बाइकार्बोनेट अपघटित होकर मैग्नीशियम या कैल्शियम कार्बोनेट बनाते हैं। ये कार्बोनेट लवण जल में अघुलनशील होते हैं। ये आसानी से पानी में नीचे बैठ जाते हैं और इस पानी को निथारा जा सकता है।
समीकरण (i) उबालनाः कठोर जल के उबालने पर उसमें उपस्थित कैल्शियम और मैग्नीशियम बाइकार्बोनेट अपघटित होकर मैग्नीशियम या कैल्शियम कार्बोनेट बनाते हैं। ये कार्बोनेट लवण जल में अघुलनशील होते हैं। ये आसानी से पानी में नीचे बैठ जाते हैं और इस पानी को निथारा जा सकता है।
(ii) सोडा-चूना द्वारा (क्लार्क पद्धति): जब निर्धारित मात्रा में बुझा हुआ चूना कठोर जल में डाला जाता है, तब घुलनशील बाइकार्बोनेट अघुलनशील कार्बोनेट में निम्नलिखित प्रक्रिया से परिवर्तित हो जाती है।
(ख) स्थायी कठोरताः जल की स्थायी कठोरता (permanent hardness) कैल्शियम तथा मैग्नीशियम के घुलनशील क्लोराइड और सल्फ़ेट लवणों की उपस्थिति के कारण होती है। इसे गैर-कार्बोनेट कठोरता (Non carbonate hardness) कहते हैं। इसे कपड़े धोने वाले सोडे और आयन विनियम पद्धति के द्वारा दूर किया जाता है।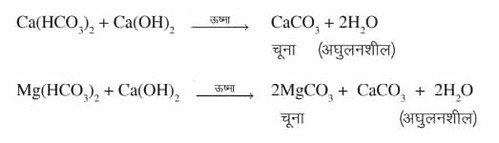 समीकरण (i) कपड़े धोने वाले सोडे (वाशिंग सोडे) को मिलाने द्वाराः कठोर जल की निर्धारित मात्रा में वाशिंग सोडा से अभिक्रिया की जाती है। वाशिंग सोडा, कैल्सियम तथा मैग्नीशियम क्लोराइड और सल्फ़ेट के साथ अभिक्रिया करके कैल्सियम और मैग्नीशियम कार्बोनेट के अवक्षेप बनाता है।
समीकरण (i) कपड़े धोने वाले सोडे (वाशिंग सोडे) को मिलाने द्वाराः कठोर जल की निर्धारित मात्रा में वाशिंग सोडा से अभिक्रिया की जाती है। वाशिंग सोडा, कैल्सियम तथा मैग्नीशियम क्लोराइड और सल्फ़ेट के साथ अभिक्रिया करके कैल्सियम और मैग्नीशियम कार्बोनेट के अवक्षेप बनाता है।
अभिक्रिया इस प्रकार हैः-
(ii) आयन विनियम पद्धति द्वाराः दो प्रकार के आयन विनिमयकों का प्रयोग किया जा सकता है। उनके नाम हैं: अकार्बनिक आयन विनिमयक और कार्बनिक आयन विनिमयक। अकार्बनिक आयन विनिमय प्रक्रम में जियोलाइट (Zeolite) नाम के संकुल यौगिकों को जल मृदुकरण के लिये प्रयोग किया जाता है। जल को कठोर बनाने वाले लवण, अघुलनशील Ca और Mg जियोलाइट अवक्षेप बनाते हैं। बड़े स्तर पर, यह प्रक्रम बड़े टैंकों या कुण्डों में किया जाता है।
इनके उपयोग के बाद कुछ समय के लिये जियोलाइट 10 % Nacl (ब्राइन) विलयन में डुबोकर पुनउर्त्पादित किया जा सकता है और तब क्लोराइड को धोकर बाहर कर देता है। इस धुलाई को अलग करके घुलनशील सोडियम लवण द्वारा इसे बदला जाता है।
कार्बनिक आयन विनियम प्रक्रम से मिला जल, धनायनों और ऋणायनों से मुक्त होता है और यह (विखनिजिकृत जल) (Demineralised water) या (Deionised water) या विआयनीकृत जल कहलाता है।
26.4.4(घ) जल की धुव्रीय प्रकृति
आयनिक यौगिकों के लिये जल बहुत प्रभावी विलायक है। यद्यपि जल अनावेशित अणु है, फि़र भी इसमें कुछ धनात्मक आवेश (H परमाणुओं पर) और ऋणात्मक आवेश (O परमाणु पर) होते हैं। यह एक ध्रुवीय विलायक है।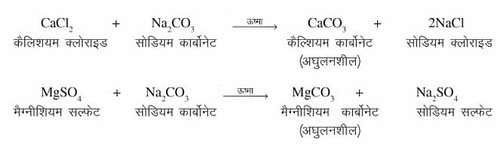 समीकरण आइए, जल की ध्रुवीय प्रकृति दर्शाने के लिये एक क्रियाकलाप करें।
समीकरण आइए, जल की ध्रुवीय प्रकृति दर्शाने के लिये एक क्रियाकलाप करें।
क्रियाकलाप 26.3
उद्देश्यः जल की ध्रुवीय प्रकृति का अध्ययन।
आपको क्या चाहिये?
ब्यूरेट, जल, ऐबोनाइट छड़ (ऋण आवेशित), काँच की छड़ (धन आवेशित) और ब्यूरेट का स्टैंड।
आपको क्या करना है?
i. ब्यूरेट या बोतल को एक अच्छे खुले मुँह के साथ जल से भर लीजिए।
ii. स्टैंड में ब्यूरेट को सीधा खड़ा कीजिए, ब्यूरेट के स्टापकार्क एक क्लिप को ढक्कन के मुँह के ऊपर लगाने से जल का प्रवाह नियंत्रित कर सकते हैं। बोतल के क्लिप को खोलकर पानी को बहने दीजिए।
3. ऐबोनाइट की छड़ को (छड़ के एक सिरे को फ़र से रगड़ कर धन आवेशित करके) पानी के नजदीक ले जाइए।
आप क्या देखते हैं? बड़े स्तर पर जल का मृदुकरण आप देखेंगे कि पानी की धारा ऋणात्मक आवेश वाली छड़ की तरफ़ आकृष्ट होती है। क्यों? क्योंकि जल के अणुओं में धनात्मक आवेश है। इसी प्रकार, अब हम कांच की छड़ जिस पर धनात्मक आवेश है, को पानी के पास ले जाएँ तो हम देखेंगे कि पुनः पानी की धारा छड़ की तरफ़ आकृष्ट हुई है। यह दर्शाता है कि जल के अणुओं में ऋणात्मक आवेश भी है। यह सिद्ध करता है जल की ध्रुवीय प्रकृति होती है।
बड़े स्तर पर जल का मृदुकरण आप देखेंगे कि पानी की धारा ऋणात्मक आवेश वाली छड़ की तरफ़ आकृष्ट होती है। क्यों? क्योंकि जल के अणुओं में धनात्मक आवेश है। इसी प्रकार, अब हम कांच की छड़ जिस पर धनात्मक आवेश है, को पानी के पास ले जाएँ तो हम देखेंगे कि पुनः पानी की धारा छड़ की तरफ़ आकृष्ट हुई है। यह दर्शाता है कि जल के अणुओं में ऋणात्मक आवेश भी है। यह सिद्ध करता है जल की ध्रुवीय प्रकृति होती है।
26.4.4(च) पृष्ठ-तनाव
पृष्ठ तनाव सभी तरल पदार्थों का गुणधर्म है। इस तनाव के कारण जल की बूँदें अपना क्षेत्रफ़ल न्यूनतम करने का प्रयास करती है। इसी कारण जल की बूँदें हमेशा गोलाकार आकृति वाली होती है।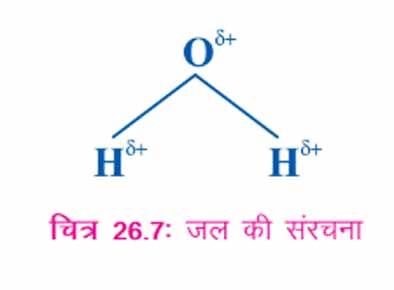 जल की संरचना जल की ऊपरी सतह पर उपस्थित जल के अणुओं द्वारा उत्पन्न तनाव पृष्ठ-तनाव कहलाता है।
जल की संरचना जल की ऊपरी सतह पर उपस्थित जल के अणुओं द्वारा उत्पन्न तनाव पृष्ठ-तनाव कहलाता है।
आइए, इसे समझने के लिये एक क्रियाकलाप करें।
क्रियाकलाप- 26.4
उद्देश्यः पृष्ठ-तनाव का अध्ययन।
आपको क्या चाहिए? गिलास और रेज़र ब्लेड
आपको क्या करना है?
पानी से भरा गिलास लें। उसमें धीरे से रेज़र ब्लेड डालें। (जिस पर मोम की एक पतली परत चढ़ी है) ताकि वह पानी की सतह पर ही रहे।
आप क्या देखते हैं?
आप देखेंगे कि पानी से भारी होने के बावजूद ब्लेड पानी की सतह पर ही रहता है।
ऐसा क्यों होता है?
पानी की सतह एक खिंची या तनी हुई परत या चादर की तरह कार्य करती है जिस पर ब्लेड टिका रहता है। यह परत तनी हुई क्यों है? अन्तराअणुक बलों के कारण यानि तरल पदार्थ की सतह के अणुओं और ब्लेड के अणुओं के बीच बल के कारण, पानी की पतली परत की सतह पर बल या खिंचाव कार्य करता है।
26.4.4(छ) केशिकात्व - पानी का चढ़ना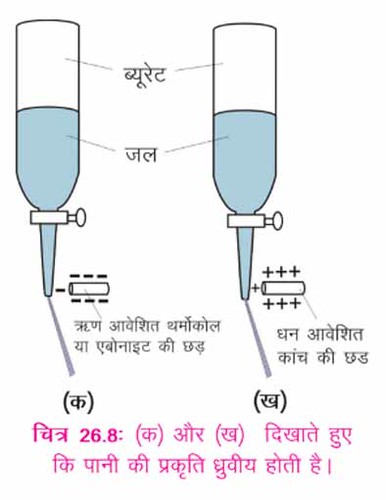 पानी की प्रकृति जब पानी में छोटे वाली केशिका नली डुबाई जाती है तो पानी केशिका में ऊपर चढ़ जाता है। पानी केशिका में कहाँ तक चढ़ेगा, यह केशिका के व्यास पर निर्भर करता है। व्यास जितना छोटा होगा, केशिका नली में पानी उतना ही अधिक ऊपर चढ़ेगा।
पानी की प्रकृति जब पानी में छोटे वाली केशिका नली डुबाई जाती है तो पानी केशिका में ऊपर चढ़ जाता है। पानी केशिका में कहाँ तक चढ़ेगा, यह केशिका के व्यास पर निर्भर करता है। व्यास जितना छोटा होगा, केशिका नली में पानी उतना ही अधिक ऊपर चढ़ेगा।
पानी के इस प्रकार केशिका में ऊपर चढ़ने को - केशिकात्व (Capillarity), केशिकात्व प्रक्रिया कहते हैं
यह वह गुणधर्म है जिसके कारण पानी मृदा से पौधों के तने द्वारा टहनियों और पत्तों में पहुँचता है।
जब कपड़ा या सोख्ता कागज का टुकड़ा पानी पर रखा जाता हो, तब वह पानी को इसी केशिका क्रिया के द्वारा सोख लेता है। कपड़े में धागे के रेशे और सोख्ता काग़ज़ में सेलुलोज/बारीक छेद वाली केशिकाओं की तरह काम करता है और पानी इनमें चढ़ जाता है।
26.4.4(झ) पानी का घनत्व
0°C से गर्म करने पर जल असामान्य व्यवहार करता है। जब तापमान 0°C से 4°C तक बढ़ता है तो जल सिकुड़ जाता है। 4°C से ऊपर यह किसी भी अन्य तरल की तरह फ़ैल जाता है। इसका मतलब यह है कि 4°C पर सबसे कम आयतन घेरता है। इस ताप पर इसका घनत्व सबसे ज़्यादा होता है और यह आस-पास के अधिक ठण्डे या गर्म जल में नीचे बैठ जाता है। जल का घनत्व 4°C पर 1 g/m3 है।
जल के इस गुण के कारण हम स्पष्ट कर सकते हैं कि एक झील को जमने में महीनों लग जाते हैं जबकि एक अत्यन्त ठण्डे दिन में एक पानी से भरी बाल्टी रात भर में जम सकती है। सतह का जल 4°C पर ठण्डा हो जाता है और अपने उच्च घनत्व के कारण झील तल की ओर धंसती है एवं गर्म जल सतह पर ऊपर आ जाता है। धीरे-धीरे सम्पूर्ण जल 4°C तक ठण्डा हो जाता है। इसके बाद शीतलन से सतह का तापमान और गिरता है और अन्ततः जल जम जाता है। बर्फ जल से हल्की होने के कारण सतह पर तैरती है। यह ऊष्मारोधी की तरह कार्य करती है और जल की निचली सतह पर शीतलन एवं बर्फ के जमने को धीमा करती है। यह स्पष्ट करता है कि जलीय निकायों में रहने वाले जलीय जन्तु अत्यंत ठण्डक के मौसम में नहीं मरते।
26.5 जल प्रदूषण
जल प्रदूषण जल निकायों जैसे झीलों, नदियों, भूमिगत जल एवं समुद्रों का संदूषण (कंटैमिनेशन) है। यह जल निकायों में अशुद्ध प्रदूषकों को छोड़ने के कारण होता है। यह केवल प्रदूषकों के छोड़े जाने वाले स्थान के निकट पौधों और जीवों को ही प्रभावित नहीं करता बल्कि प्रदूषित जल के परिवहन के साथ अन्य स्थानों की भी यात्रा करता है।
जल प्रदूषण के विभिन्न स्रोत
जल प्रदूषण के विभिन्न स्रोत हैं:-
1. उद्योग जो विभिन्न विषाक्त तत्व एवं भारी धातुएँ व औद्योगिक विलायक प्राकृतिक जल निकायों में छोड़ते हैं।
2. खेतों से मुक्त होने वाले उर्वरक और कीटनाशी जो कि यूट्रॉफि़केशन एवं बायोमैग्नीफि़केशन को बढ़ावा देते हैं।
3. खनन से भारी धातुएँ एवं सल्फ़र पृथ्वी में गहराई तक समाकर जल निकायों में पहुँच जाता है।
4. गन्दे पानी के पाइप एवं मैले पानी के नालियाँ व गड्ढे विभिन्न रोगजनक, संक्रमण एवं डिटरजेंट को फ़ैलाते हैं।
5. वायु प्रदूषण के फ़ैलने वाले प्रदूषण जैसे सल्फ़र डाइऑक्साइड, नाइट्रोजन के ऑक्साइड आदि वर्षा द्वारा घुल जाते हैं।
7. खाद्य प्रसंस्करण इकाइयाँ एवं उनका कचरा जिसमें वसा एवं चिकनाई शामिल है।
अपनी उत्पत्ति के आधार पर जल प्रदूषकों के स्रोतों को सामान्यतः दो वर्गों में बाँटते हैं:
सुस्पष्ट स्रोत प्रदूषकः ऐसे प्रदूषक हैं जो जल निकाय में एक एकल पहचान वाले स्रोत से पहुँचते हैं जैसे पाइप या गड्ढा।
अस्पष्ट स्रोत प्रदूषक विसरित प्रदूषक हैं जो एक एकल पृथक स्रोत द्वारा उत्पन्न नहीं होते बल्कि यह एक बड़े भाग से एकत्र प्रदूषकों का संचयित प्रभाव है जैसे कि कृषि भूमि से उर्वरकों एवं कीटनाशकों का बह कर आना।
पाठगत प्रश्न 26.4
1. यह कहा जाता है कि पृथ्वी का अधिकांश भाग भूमि की बजाय जल है। पृथ्वी की कितनी सतह जल से घिरी है?
2. जल के दो स्रोतों के नाम बताइए।
3. वर्षा जल शुद्ध है या अशुद्ध? अपना उत्तर एक कारण के साथ दीजिए।
4. जल को शुद्ध करने हेतु क्लोरीनीकरण से क्या अभिप्राय है?
5. अपने हाथ धोने के दौरान मैं साबुन से झाग नहीं बना सका, यह किस प्रकार का जल है?
6. Ca2+ या Mg2+ के बाई कार्बोनेट की उपस्थिति के कारण जल में जो कठोरता आती है, उसका प्रकार बताएँ।
7. Ca2+ या Mg2+ के सल्फ़ेट या क्लोराइड की उपस्थिति के कारण होने वाली कठोरता का प्रकार बताएँ।
8. निम्नांकित द्वारा किस प्रकार की कठोरता दूर होती हैः (i) उबाला (ii) आयन विनिमय पद्धति
9. क्या जल विलायक है या अध्रुवीय विलायक? आप ऐसा क्यों सोचते हैं?
10. किस तापमान पर जल कम से कम जगह घेरता है?
26.6 जल की उपयोगिता
जल का प्रयोग बहुत से कार्यों के लिये किया जाता है जिसमें फ़सल उगाना, धातुमय क्रियाओं से तांबे जैसी धातु प्राप्त करना, विद्युत उत्पादन, बाग-बगीचों (lawns) में पानी देना, सफ़ाई, पीना तथा मनोरंजन सम्मिलित है। हम कह सकते हैं कि प्राणियों के जीवन के लिये जल एक अनिवार्य पदार्थ है। बिना जल के पौधों और प्राणियों की कोशिकाएँ काम नहीं कर सकतीं और वे जीवित नहीं रह सकते। आइए, घरेलू कार्यों, कृषि, उद्योगों तथा विद्युत उत्पादन में जल की भूमिका के बारे में पढ़ें।
26.6.1 जल का घरेलू कार्यों में प्रयोग
घरेलू कार्यों को करने में जल महत्त्वपूर्ण भूमिका निभाता है। उदाहरण के लिये, जल, खाना पकाने, बर्तन और कपड़े धोने तथा घर का फ़र्श साफ़ करने के काम आता है। यह सफ़ेदी कराने के भी काम आता है। यह नहाने के काम आता है। जल शरीर के व्यर्थ पदार्थों जैसे मल-मूत्र इत्यादि को विलेय कर लेता है। अतः यह शरीर के व्यर्थ पदार्थों को निकालने का एक अच्छा माध्यम है। भोजन के पोषक तत्त्व तथा लवण जल में घुल जाते हैं। इसलिये ये पोषक तत्त्व आसानी से हमारी शरीर द्वारा अवशोषित कर लिये जाते हैं। इस प्रकार भोजन में उपस्थित अनेक पोषक तत्वों को एकत्र करने में मदद करता है। कृप्या जल के सार्वत्रिक विलायक के गुण को पुनः याद करें।
26.6.2 जल का कृषि में प्रयोग
कृषि क्षेत्र में, जल फ़सलों की सिंचाई के लिये प्रयोग किया जाता है। यह बीज के अंकुरण और पौधों के विकास में सहायक होता है। खाद द्वारा दिए गए पोषक तत्त्व पानी में घुल जाते हैं। इन घुले पोषक तत्वों को पौधे आसानी से आत्मसात् कर लेते हैं। पौधों को प्रकाश संश्लेषण द्वारा अपना भोजन तैयार करने के लिये जल (कार्बन डाइ ऑक्साइड के साथ) की आवश्यकता होती है। ये पौधों के एक भाग से दूसरे भाग में खनिज और पोषक तत्वों को पहुँचाने का कार्य करता है।
जल जलीय पौधों एवं जन्तुओं को निवास प्रदान करता है।
26.6.3 जल के औद्योगिक प्रयोग
उद्योगों में जल शीतलक के रूप में प्रयुक्त होता है। इसका प्रयोग बर्फ के उत्पादन में भी होता है। इसका औद्योगिक बॉयलरों (Boilers) तथा भाप ईंजनों में भाप के उत्पादन में प्रयोग होता है। इसका अनेक औद्योगिक प्रक्रमों में विलायक की भांति प्रयोग होता है। जल का प्रयोग अनेक रासायनिक यौगिकों को बनाने में होता है। उदाहरण के लिये, जल में SO3 को घोलने पर H2SO4 बनता है तथा जल में NO2 को घोलने पर HNO3 बनता है। जल का प्रयोग हाइड्रोजन गैस और भाप-अंगार गैस ईंधन बनाने में भी होता है।
26.6.4 विद्युत उत्पादन में जल का प्रयोग
जल से ऊर्जा प्राप्त करने के विभिन्न तरीक़े हैं। इस ऊर्जा को प्राप्त करने का सबसे साधारण तरीक़ा जल-विद्युत शक्ति है। जल को ऊपर से गिरा कर टर्बाइन चलाई जाती है, जिसके कारण विद्युत उत्पादन होता है।
जल का प्रयोग तापीय और नाभिकीय पावर स्टेशनों में भाप उत्पन्न करके विद्युत निर्माण में किया जाता है।
26.7 वर्षा के जल का संरक्षण
वर्षों से जनसंख्या बढ़ने के कारण औद्योगीकरण में प्रगति तथा कृषि के विस्तार से जल की मांग बढ़ गई है। दूसरी ओर जल स्रोत जैसे भूमिगत जल एवं नदी का जल तेज़ी से सूख रहे हैं।
जल के समझदारी से संरक्षण की आज ज़रूरत है और इसके लिये विभिन्न दिशाओं में प्रयास किए जा रहे हैं जैसे कि बांध और जलाशय बनाकर और भूमि के अंदर कुओं जैसा ढांचा बनाकर जल एकत्रित करने के प्रयास किए गए हैं, जल के पुनउर्पयोग एवं अलवणीय करण की। कोशिश भी की गई है। भूमिगत जल का पुनर्भरण आवश्यक हो गया है। यह वर्षा जल संग्रहण के द्वारा किया जा रहा है।
वर्षा के जल का संग्रहण का अर्थ यह है कि भवनों की छत पर वर्षा के जल को एकत्र कर, बाद में उपयोग के लिये भूमिगत भरण करना। यह पुनर्भरण न केवल भूमिगत जल को समाप्त होने से बचाता है। बल्कि जल के घटते स्तर को बढ़ाता है और जल आपूर्ति में सहायता करता है।
चाहे बहुत से लोग यह महसूस न करें, परंतु कुछ सेंटीमीटर वार्षिक वर्षा भी एक बहुमूल्य संसाधन है। वर्षा के जल संग्रहण से न केवल स्थानीय बाढ़ की संभावना को कम करने में मदद मिलती है अपितु घरेलू इस्तेमाल के लिये भूमिगत जल पर निर्भरता भी कम हो जाती है। वर्षा का जल सब्जियों व फ़ूलों की फ़सलों की सिंचाई के लिये, रूम कूलर, धुलाई और अन्य अनेक घरेलू कार्यों के लिये उपयुक्त है। वर्षा का जल इसका उपयोग घरेलू कार्यों के लिये किया जाता है।
वर्षा जल के उपयोग के दौरान कठोर निक्षेप जमा नहीं होते और साबुन के झाग (स्कम) की समस्या नहीं आती। संचयित जल व्यक्तिगत उपभोग के लिये भी इस्तेमाल हो सकता है, लेकिन यह उपयोग से पूर्व अवश्य ही फि़ल्टर किया हुआ (छना हुआ) और शोधित होना चाहिए। वर्षा जल जो आपके घर या खेत में गिरता है, उसके बहाव में कमी लाकर, आप अपने घर के आस-पास काम करने के लिये एक मूल्यवान जल संसाधन बना सकते हैं।
इस प्रकार वर्षा के जल संग्रहण के लाभों के सारांश को इस प्रकार से प्रस्तुत किया जा सकता है
i. मूल्यवान भूमिगत जल का संरक्षण होता है।
ii. स्थानीय बाढ़ और जल निकास की समस्या को कम करता है।
iii. भूदृश्य निर्माण और सम्पत्ति रख-रखाव की जरूरत को कम करता है।
iv. अनेक घरेलू कार्यों के लिये उत्तम गुण वाला जल प्रदान करता है।
v. इसका प्रयोग घरेलू कार्यों जैसे सब्ज्यिों, फ़ूलों, पेड़ों, पौधों को उगाने तथा ग्रीन हाउस में अंकुरण के लिये किया जा सकता है।
पाठगत प्रश्न 26.5
1. वर्षा जल संचयन के कोई दो उपयोग बताइए।
2. उद्योग एवं कृषि जल के बेहद अभाव की घटना में किस स्थिति से गुज़रते हैं?
3. वर्षा जल भूमिगत जल के लिये क्या करता है?
4. वर्षा जल साबुन से धुलाई के लिये उपयुक्त क्यों साबित हुआ है?
आपने क्या सीखा
1. वायु के प्रमुख घटक नाइट्रोजन और ऑक्सीजन हैं। वायु में ऑर्गन, कार्बन डाइऑक्साइड तथा कुछ अन्य गैसें जैसे निऑन, हीलियम, क्रिप्टॉन और ज़ेनॉन भी होती है। इसमें जल-वाष्प भी होते हैं।
2. भू-तल के किसी क्षेत्रीय इकाई पर लगने वाला वायुमंडल का दाब वायुमंडलीय दाब कहलाता है।
3. वायुमण्डलीय दाब हमारे जीवन के प्रतिदिन के कार्यों जैसे स्याही ड्रॉपर, जल पम्प आदि के कार्य करने में महत्त्वपूर्ण भूमिका निभाता है।
4. किसी निश्चित ताप पर वायु में विद्यमान नमी की मात्रा आर्द्रता कहलाती है।
5. वायु के बाद हमें सबसे अधिक मिलने वाला पदार्थ जल है। जल के प्राकृतिक स्रोत वर्षा, झील, कुएँ, नदियाँ और समुद्र हैं। समुद्र विविध खनिजों का एक उत्कृष्ट स्रोत है।
6. जल की निम्नलिखित विशेषताएँ इसे हमारे दैनिक जीवन के लिये बहुत उपयोगी बना देती हैः
(i) सभी वस्तुओं को घोलने की क्षमता अर्थात सार्वत्रिक विलायक की तरह कार्य करता है।
(ii) झाग बनाना
(iii) पृष्ठ तनाव
(iv) केशिकात्व
(v) 4°C पर जल का घनत्व 1 g cm-3 होता है।
7. देश के जल स्रोतों का उचित और न्यायसंगत प्रयोग के लिये प्रबंधन बांधों, नहरों, जलाशयों, कुओं और ट्यूबवेलों का निर्माण करके किया जाता है। बांधों में एकत्रित जल का इस्तेमाल न केवल सिंचाई के लिये अपितु विद्युत उत्पादन के लिये भी किया जाता है।
8. जल प्रदूषण एवं वायु प्रदूषण मानवीय गतिविधियों के कारण होते हैं।
9. वर्षा के जल का संरक्षण भूमिगत पुनर्भरण द्वारा किया जा सकता है या उसे अन्य कामों में प्रयोग किया जा सकता है। यह वर्षा के जल का संग्रहण कहलाता है।
पाठांत प्रश्न
1. बहुविकल्पीय प्रश्न
i. वायु निम्नलिखित में से क्या है?
(क) यौगिक
(ख) तत्त्व
(ग) मिश्रण
(घ) इनमें से कोई नहीं
ii. वायु के मुख्य घटक हैं?
(क) CO2 और H2 O
(ख) N2 और O2
(ग) CO2 और Hw
(घ) H2 O और Xe
iii. आर्द्रता मापने के लिये प्रयोग होने वाला यंत्र है।
(क) बैरोमीटर
(ख) हाइग्रोमीटर
(ग) लैक्टोमीटर
(घ) इनमें से कोई नहीं
iv. जल का अधिकतम घनत्व किस तापमान पर होता हैः
(क) 0°C
(ख) 10°C
(ग) 5°C
(घ) 4°C
2. हमारे जीवन में ऑक्सीजन और नाइट्रोजन की उपयोगिता को सूचीबद्ध कीजिए।
3. वायुमण्डलीय दबाव क्या है?
4. ऊँचाई पर वायुमण्डलीय दबाव किस तरह आश्रित है?
5. एक क्रियाकलाप दीजिए जो यह सिद्ध करे कि वायु दबाव बनाती है।
6. आपेक्षिक आर्द्रता क्या है?
7. जल के विभिन्न स्रोत क्या हैं? किन्हीं दो के विषय में बताइए।
8. जल सार्वत्रिक विलायक क्यों कहलाता है?
9. पीने योग्य जल के शुद्धीकरण के कौन से विभिन्न तरीके हैं? क्लोरीनीकरण की क्या भूमिका है?
10. आप कठोर एवं मृदु जल से क्या समझते हैं? पानी में कठोरता के प्रकारों को स्पष्ट कीजिए।
11. जल से किस प्रकार स्थायी व अस्थायी कठोरता दूर की जा सकती है?
12. जल के निम्नांकित गुणों को स्पष्ट करें:
(i) पृष्ठ तनाव (ii) घनत्व
13. वर्षा जल संवर्धन क्या है? यह प्रतिदिन के जीवन के लिये कैसे लाभकारी है?
14. वातावरण में कार्बन डाइ ऑक्साइड की उपस्थिति क्यों अनिवार्य है? दो कारण दीजिए।
15. ऑक्सीजन के कोई दो औषधीय उपयोग दीजिए।
16. प्राथमिक और द्वितीयक वायु प्रदूषक क्या है?
प्रत्येक का एक उदाहरण दीजिए।
17. निम्नांकित प्रदूषकों के क्या स्रोत हैं:
(i) क्लोरोफ्लोरो कार्बन
(ii) नाइट्रोजन ऑक्साइड
(iii) कणिकीय पदार्थ
18. निम्नांकित पदार्थ वायु प्रदूषक क्यों माने जाते हैं:
(i) कार्बन मोनोक्साइड
(ii) कार्बन डाइ ऑक्साइड
(iii) सल्फ़र ऑक्साइड
(iv) वाष्पशील कार्बनिक यौगिक
19. (i) फ़ोटोकेमिकल धूम-कोहरा (स्मोग) एवं
(ii) भूतल ओज़ोन क्या हैं?
20. (i) सुस्पष्ट स्रोत प्रदूषक एवं
(ii) अस्पष्ट स्रोत प्रदूषक क्या हैं? प्रत्येक का एक उदाहरण दीजिए।
21. निम्नांकित में प्रत्येक के लिये जल के कोई दो उपयोग बताइए
(i) घरेलू
(ii) औद्योगिक एवं
(iii) कृषि कार्य
22. आप जल के संरक्षण से क्या समझते हैं? यह किस प्रकार उपयोगी है?
23. आप निवासी कल्याण संगठन के प्रभारी हैं? जल के संरक्षण की आवश्यकता पर जागरुकता के लिये निवासियों को जागरुक करने हेतु दो स्लोगन (नारे) तैयार कीजिए।
24. जीवधारियों के आस-पास का वायुमंडलीय आवरण जीने के लिये आवश्यक गैसें उपलब्धा कराता है। ये गैसें कौन सी हैं, इनका वायु में क्या अनुपात है और जीवित रहने के लिये ये किस प्रकार जिम्मेदार हैं?
25. वर्षा जल वायु प्रदूषण के साथ जल निकायों को किस तरह प्रभावित करता है?
26. जल के पाँच गुणों को स्मरण कीजिए एवं इस तथ्य के समर्थन में एक वाक्य लिखिए कि जल एक अनिवार्य स्रोत है।
27. कठोर जल को उबाल कर कैसे इस प्रकार परिवर्तित कर सकते हैं कि वह कपड़ों को धोने के लिये उपयोग किया जा सकता है।
पाठगत प्रश्नों के उत्तर
26.1
1. मिश्रण
2. नाइट्रोजन एवं ऑक्सीजन, ऑक्सीजन
3. नाइट्रोजन
4.यह स्थान, स्थान पर परिवर्तित होता है।
26.2
1. पौधों और जानवरों के श्वसन के लिये आवश्यक, जानवर मर जाएँगे।
2. प्रकाश संश्लेषण
3. ठोस CO2 , प्रशीतक की तरह उपयोग होता था।
4. नाइट्रोजन
26.3
1. यह ऊँचाई पर घटता जाता है।
2. यह ऊँचाई वाले स्थानों पर शरीर की रक्त वाहिकाओं में वायु दाब की अपेक्षा रक्त दाब के अधिक होने के कारण होता है, अतः वाहिकाएँ फ़ट जाती हैं और रक्त बहता है।
3. (i) ट्रोपोस्फ़ीयर (ii) थर्मोस्फ़ीयर
4. स्ट्रोटोस्फ़ीयर
5. (i) मीथेन (ii) सल्फ़र ऑक्साइड (iii) क्लोरो-फ्लोरो-कार्बन (सी.एफ़.सी.)
26.4
1. तीन चौथाई
2. वर्षा एवं समुद्र (या कोई अन्य)
3. शुद्ध/आसवित
4. सूक्ष्मजीवों को मारता है
5. कठोर जल
6. अस्थायी कठोरता
7. स्थायी कठोरता
8- (i) अस्थायी (ii) स्थायी
9. 4° C
26.5
1. (i) यह मूल्यवान भूमिगत जल का संरक्षण करता है।
(ii) यह स्थानीय बाढ़ एवं अपवहन (ड्रेनेज) समस्याओं को कम करता है।
(iii) यह भूदृश्य एवं सम्पत्ति के रख-रखाव की आवश्यकताओं को कम करता है।
(iv) यह घर की कई आवश्यकताओं के लिये बेहतर गुणवत्ता का जल प्रदान करता है।
(v) यह घरेलू उद्देश्य के लिये उपयोग हो सकता है। (कोई दो)
2. उद्योगः शीतलक का उद्देश्य, भाप के उत्पादन में, कई रसायनों के लिये विलायक का प्रयोग प्रभावित हो सकता है। कृषिः फ़सलों की सिंचाई बीजों का अंकुरण एवं पौधों की वृद्धि प्रभावित हो सकती है।
3. क्षीण जल स्तर को उठाता है।
4. क्योंकि वर्षा जल मृदु जल अवस्था में होता है।
|
TAGS |
|
how much water is in the air at 50 humidity in hindi, how to calculate water vapor in the air in hindi, moisture content of air calculator in hindi, water vapor content calculator in hindi, saturation vapor pressure equation in hindi, volume of water in air at given humidity calculator in hindi, saturation vapor pressure equation air in hindi, psychrometric equations excel in hindi, temporary hardness of water definition in hindi, equation for removal of temporary hardness by heating in hindi, how to remove temporary hardness of water in hindi, difference between temporary and permanent hardness of water in hindi, temporary hardness of water formula in hindi, temporary hardness may be removed from water by adding in hindi, temporary and permanent hardness of water ppt in hindi, temporary and permanent hardness of water pdf in hindi, deionised water vs distilled water in hindi, how to make deionized water in hindi, where to buy deionized water in hindi, what is deionized water used for in hindi, deionized water formula in hindi, deionized water walmart in hindi, deionized water ph in hindi, deionized water definition in hindi |







